Bindungsformen
Edelgas-Konfiguration
Atome gehen Bindungen miteinander ein um "Edelgas-Konfiguration" zu erreichen. Bei den Edelgasen befinden sich auf der äußersten Schale immer 8 Elektronen (beim Helium nur 2 Elektronen). Dieser Zustand hat sich als energetisch sehr günstig erwiesen. Aus diesem Grund wird versucht, diesen Zustand durch verschiedene Arten der Bindung zu erreichen.
Ionenbindung

Die Ionenbindung besteht aufgrund der Anziehung zwischen Kationen und Anionen. In der Ionenbindung gibt das Kation dem Anion ein Elektron ab, sodass beide Elemente den Zustand der Edelgaskonfiguration erreichen. Die Ionenbindung wird häufig von Elementen der 1. und 2. zusammen mit Elementen der 6. und 7. Hauptgruppe eingegangen.
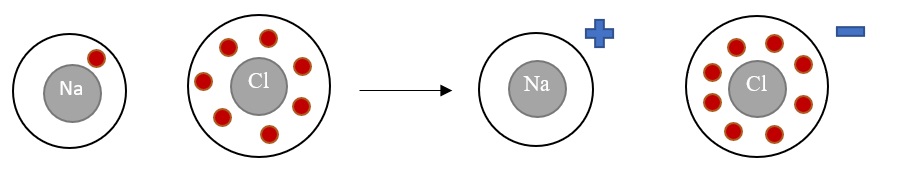
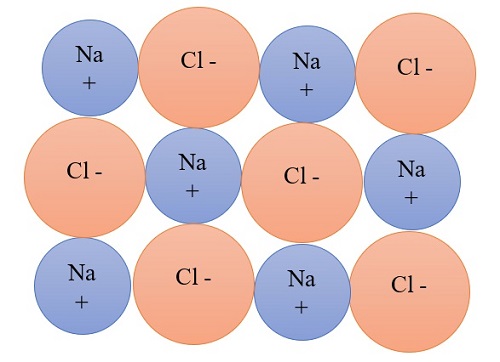
Stoffe, die aus Anionen und Kationen bestehen, werden "Salze" genannt. In einem Salz sind die Ionen regelmäßig in einem Ionengitter angeordnet. Häufig haben diese Stoffe einen kristallinen Charakter. Im gelösten oder geschmolzenen Zustand können diese Stoffe durch die Bewegung der Elektronen den elektrischen Strom leiten.
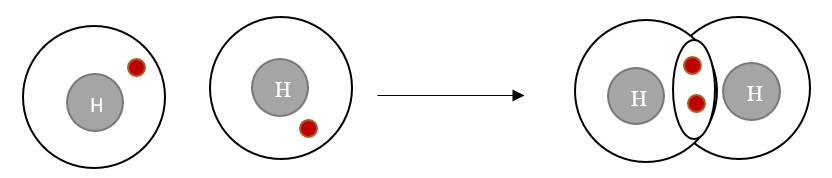
Elektronenpaarbindung
Elektronenpaarbindungen werden zwischen Nichtmetallen aufgebaut. Sie besteht zwischen jeweils einem Außenelektron von zwei Bindungspartnern. Da in einer Elektronenpaarbindung die zwei betroffenen Elektronen jeweils zu beiden Bindungspartnern zugeordnet werden, können Atome mit einer bestimmten Anzahl an Bindungspartnern die Edelgaskonfiguration erreichen.
Wasserstoffbrückenbindung
Die Wasserstoffbrückenbindung ist eigentlich keine richtige Bindung und besteht aufgrund der Tatsache, dass das Molekül Wasser einen Dipol-Molekül ist. Das bedeutet, dass beim Sauerstoff eine negative und beim Wasserstoff eine positive Partialladung existiert. Dadurch ziehen sich die Wassermoleküle untereinander an. Diese Anziehung wird immer zwischen Wasserstoff und Sauerstoff ausgeprägt. Daraus resultieren bestimmte Eigenschaften des Wassers, wie z.B. das Prinzip der Oberflächenspannung.

Metallbindung
Die metallische Bindung besteht aus positiv geladenen Atomrümpfen und dem Elektronennebel. Die Atomrümpfe befinden sich auf festen Plätzen. Sie bestehen aus dem Atomkern sowie den vollbesetzten Elektronenschalen. Die Valenzelektronen verlassen ihre äußerste Schale und bewegen sich als Elektronennebel um die Atomrümpfe herum.
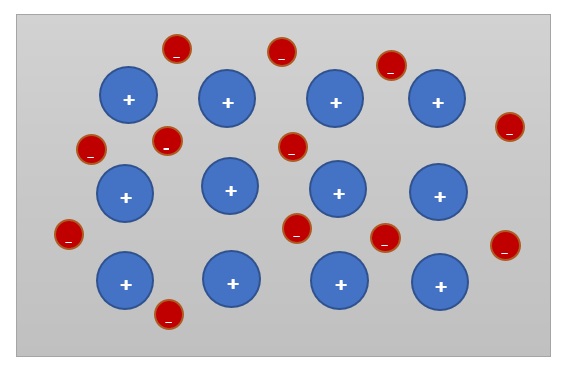
Metalle kennzeichnen sich durch eine glatte Oberfläche aus. Sie sind gute Wärmeleiter und leiten ebenfalls gut den elektrischen Strom. Verbindungen zweier Metalle werden auch "Legierungen" genannt.
Van-der-Waals-Kräfte
Die Van-der-Waals-Kräfte sind genau genommen keine wirklichen Bindungen, sondern schwache Kräfte zwischen Molekülen. Sie existieren in vielen Verbindungen. Die Van-der-Waals-Kräfte entstehen dadurch, dass die Elektronen eines Moleküls sich in Bewegung befinden. Dadurch sind die Ladungen innerhalb des Moleküls kurzzeitig ungleichmäßig verteilt. Dieser Zustand wird auch "Dipol" genannt. Positive und negative Seiten zweier Moleküle können sich gegenseitig anziehen. Durch diese Bewegungen bilden sich in den umliegenden Molekülen weitere Dipole aus. Die Moleküle induzieren sich gegenseitig.

Je größer das Molekül ist, desto stärker wirken die Van-der-Waals-Kräfte. Bei Kohlenwasserstoffverbindungen ist dadurch die Siedetemperatur höher je langkettiger das Molekül ist.
